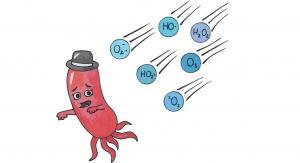
Czy tlen jest trucizną?
Słysząc słowo tlen od razu przychodzi nam na myśl czynnik niezbędny do życia. Jednak czy zawsze tak jest? Jak dowiedli naukowcy, tlen może wykazywać działanie toksyczne wobec bakterii, występując pod postacią tzw. form reaktywnych. Jego działanie na komponenty komórek mikrobów nieraz prowadzi do ich śmierci. Niewątpliwie jest to więc paradoks – element konieczny do życia, a zarazem trucizna.
Tlen jest nam niezbędny do życia. Pobierany przez nas z powietrza pozwala na poprawne funkcjonowanie naszego organizmu. Lecz nie tylko dla zwierząt tlen stanowi niezbędny element środowiska. Korzystają z niego rośliny, a także niektóre mikroorganizmy. Czy może więc wystąpić sytuacja w której czynnik niezbędny do życia może stać się trucizną? Oczywiście, tak właśnie jest z tlenem. Podczas metabolizmu mogą powstawać reaktywne formy tlenu (ROS), które nie usunięte odpowiednio szybko mogą prowadzić nawet do śmierci organizmu. Co więcej powstawanie tych form może być następstwem działania na organizm różnego rodzaju stresorów.
Reaktywne formy tlenu to pojęcie dość szerokie. Określa ono postacie tego pierwiastka, które stosunkowo łatwo mogą wchodzić w interakcje z biomolekułami i je uszkadzać (Cabiscol, Tamarit and Ros, 2000). Zasadniczym kryterium ich podziału jest posiadanie niesparowanych elektronów (rodniki) lub ich brak. Do rodników zaliczamy anionorodnik ponadtlenkowy (O2-•), rodnik wodoronadtlenkowy (HO2•) i rodnik hydroksylowy (HO•). Natomiast drugą grupę reaktywnych form tlenu stanowi tlen singletowy (1O2), ozon (O3) oraz nadtlenek wodoru (H2O2). Opisywane formy tlenu różnią się także reaktywnością. Wśród podanych najłatwiej reaguje tlen singletowy oraz nadtlenek wodoru, a najsłabiej anionorodnik ponadtlenkowy. Nie oznacza to jednak, że nie jest on szkodliwy. Charakterystyczne dla reaktywnych form tlenu jest to, że jedna forma może przechodzić w drugą. W ten sposób pozornie mało reaktywny anionorodnik ponadtlenkowy może stać się sporym zagrożeniem ulegając przemianie do nadtlenku wodoru, rodnika hydroksylowego czy tlenu singletowego (Sigler et al., 1999).
Jednym z głównych „celów” uszkadzanych przez reaktywne formy tlenu jest DNA. Najczęściej dochodzi do utleniania zasad azotowych przez rodniki hydroksylowe. Pierwszym przykładem będzie tymina, której utlenianie prowadzi do powstania glikolów tyminy. Pojawienie się ich w jednoniciowym DNA powoduje mutacje punktowe, ponieważ zmodyfikowana tymina łączy się z cytozyną. Jeśli jednak glikol tymina pojawi się w dwuniciowym DNA, toksyczny efekt polega na zaburzeniu procesu replikacji. Cytozyna w drodze utleniania staje się glikolem cytozyny i jako związek nietrwały ulega kolejnej przemianie do hydratu cytozyny. Następnym etapem jest jego deaminacja, a produktem tego ciągu reakcji są pochodne uracylu. Wykazują one powinowactwo do wiązania się z adeniną, co sprzyja występowaniu tranzycji. Analogicznie do opisanych przykładów zachodzi utlenianie zasad purynowych, a produkty tych reakcji także powodują powstawanie mutacji. Ciekawym zagadnieniem jest to, że reaktywne formy tlenu mogą działać także na deoksyrybozę. Powodują one fragmentację tego cukru, a co za tym idzie pęknięcia nici DNA (Sigler et al., 1999).
Kolejnym elementem uszkadzanym w komórce przez reaktywne formy tlenu są lipidy. Ich utlenianie stanowi zagrożenie głównie dla integralności błony komórkowej, która zbudowana jest z fosfolipidów. Następstwem nieciągłości błony komórkowej jest utrata kontroli nad jej przepuszczalnością, a w efekcie zanik prawidłowego gradientu protonowego. Wynikiem tych zmian może być śmierć komórki. Należy też zauważyć, że w procesie peroksydacji lipidów powstając produkty uboczne tzw. stresory drugorzędowe. Mogą to być kolejne rodniki tlenowe np. rodnik wodoronadtlenkowy, ale także ketony i aldehydy. Stresory drugorzędowe mogą uszkadzać kolejne struktury komórkowe – białka i materiał genetyczny, prowadząc w końcu śmierci komórki.
Istotną biomelukułą która ulega degradacji przy udziale reaktywnych form tlenu są białka. Dotyczy to zarówno białek strukturalnych, jak i enzymatycznych. Głównym mechanizmem jest utlenianie aminokwasów. Może to następować w sposób wybiórczy, czyli utlenieniu ulegają pojedyncze aminokwasy. Często jednak zdarza się, że utlenieniu ulegają także sąsiednie aminokwasy. Powstająca w ten sposób reakcja łańcuchowa powoduje kolejne reakcje utlenienia, które prowadzą do nieodwracalnych uszkodzeń białek. Degradacja enzymów najczęściej odbywa się poprzez oksydację miejsc przyłączania grup prostetycznych. Szczególną uwagę należy zwrócić także na dużą ilość grup sulfhydrylowych w centrach aktywnych enzymów, ze względu na to że są one często „atakowane” przez nadtlenek wodoru. Utlenienie tych grup powoduje oczywiście unieczynnienie enzymu (Sigler et al., 1999). Brak aktywności enzymów pociąga za sobą wiele konsekwencji. Wiele reakcji zachodzących w komórce wymaga ich katalizy. Co więcej enzymy są także odpowiedzialne za unieszkodliwianie reaktywnych form tlenu. Zbyt wysokie stężenie ROS powoduje uszkodzenia np. w łańcuchu oddechowym czego wynikiem jest wzrost ich ilości. Coraz większe ilości ROS powodują kolejne uszkodzenia w komórce, aż w końcu jej śmierć.
Skupmy się teraz na pochodzeniu reaktywnych form tlenu. Jak zostało wspomniane wyżej mogą one pochodzić z metabolizmu komórki, ale także mogą powstawać w odpowiedzi na działanie stresora. Taki stresorem mogą być metale ciężkie, promieniowanie UV oraz nanocząstki. Szczególną uwagę należy poświęcić tym ostatnim. Jest to dość nowe zagadnienie, ale już teraz wiadomo, że nanocząstki żelaza i tlenku magnezu mogą indukować powstawanie ROS w komórkach Escherichia coli oraz Staphylococcus aureus (Bekier, Krzyżowska and Sadowska, 2019). Na E.coli testowano także nanocząstki tlenku cynku oraz tlenku tytanu. Ich działanie antybakteryjne, odbywające się według opisywanych wcześniej mechanizmów, również zostało potwierdzone (Leung et al., 2016).
Reaktywne formy tlenu stanowią poważne zagrożenie dla organizmów żywych. Tym większy wydaje się paradoks, że tlen jest im jednocześnie niezbędny do życia. Właściwości antybakteryjne ROS są często wykorzystywane ze względu na to, że uszkadzają nie tylko funkcjonalne komórki, ale także przetrwalniki (Sigler et al., 1999). Degradacja biomolekuł umożliwiających poprawne działanie komórek oraz ilość dróg jakimi może się odbywać niszczenie tych struktur niewątpliwie potwierdza, że tlen jest trucizną. Należy jednak podkreślić, że tylko w niektórych formach.
Bibliografia:
Bekier, A., Krzyżowska, M. and Sadowska, B. (2019) ‘Nanocząstki Metali – Wykorzystanie W Leczeniu Zakażeń’, Kosmos, 67(4), pp. 875–888. doi: 10.36921/kos.2018_2407.
Cabiscol, E., Tamarit, J. and Ros, J. (2000) ‘Oxidative stress in bacteria and protein damage by reactive oxygen species’, International Microbiology, 3(1), pp. 3–8. doi: 10.2436/im.v3i1.9235.
Leung, Y. H. et al. (2016) ‘Toxicity of ZnO and TiO2 to Escherichia coli cells’, Scientific Reports, 6(June), pp. 1–13. doi: 10.1038/srep35243.
Sigler, K. et al. (1999) ‘Oxidative stress in microorganisms - I: Microbial vs. higher cells - Damage and defenses in relation to cell aging and death’, Folia Microbiologica, 44(6), pp. 587–624. doi: 10.1007/BF02825650.
Artykuł powstał w ramach programu MNiSW „Mistrzowie dydaktyki” w czasie zajęć tutoringowych we współpracy między p. Karoliną Badurą, studentką II roku biotechnologii i dr Sławomirem Sułowiczem na Wydziale Nauk Przyrodniczych Uniwersytetu Śląskiego w Katowicach. Projekt jest współfinansowany ze środków Europejskiego Funduszu Społecznego.