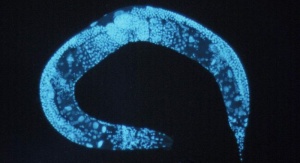
Sekret starzenia się odkryty w... badaniach na robakach
Badacze z dwóch amerykańskich placówek – Case Western Reserve University School of Medicine i University Hospitals Health System – odkryli nowy molekularny sposób na kontrolę długości życia i zdrowia, działąjącą u robaków i u myszy. Ich dalsze badania mogą otworzyć drogę do realizacji wielkiego ludzkiego marzenia o długowieczności.
W artykule opublikowanym właśnie w czasopiśmie „Nature Communications” naukowcy pokazują, że robaki z podwyższonym poziomem pewnych protein żyją dłużej i są zdrowsze niż zwykle robaki. Ponadto, myszy, które mają podwyższony poziom tych samych protein, wykazują opóźnienie w pojawianiu się dysfunkcji układu naczyń krwionośnych w porównaniu do typowych przedstawicieli ich gatunku. Badanie może mieć doniosłe znaczenie w naszym rozumieniu starzenia się i powiązanych z tym problemów życiowych.
– Odkryliśmy, że przez sztuczne podnoszenie albo obniżanie poziomu białek KLF (Kruppel-like transcription factors) możemy faktycznie wydłużyć lub skrócić życie tych niewielkich robaków (nicieni gatunku Caenorhabditis elegans) – wyjaśnia dr Nelson Hsieh z Case Western Reserve University School of Medicine (CWRU), pierwszy autor publikacji. – Najbardziej fascynujące jest jednak to, że ta sama rodzina białek występuje u ssaków i nasze dane świadczą o tym, że u ssaków obserwujemy podobną zależność.
– Obserwujemy obniżanie się poziomu białek KLF wraz z wiekiem i widzimy także, że podtrzymywanie go na wcześniejszym poziomie może przyczynić się do zahamowania degradacji naczeń krwionośnych, a tym samym ograniczenia związanych z tym dysfunkcji naczyniowych, takich jak nadcińsnienie, choroby serca i demencja – dodaje prof. Mukesh K. Jain z CWRU.
W dalszych badaniach udało się ustalić, że praca białek KLF polega na kontroli autofagii, czyli procesu oczyszczania się komórek przez trawienie obumarłych lub uszkodzonych elementów. Utrata kontroli nad tym procesem jest cechą charakterystyczną starzenia się.
– Wraz z wiekiem komórki obniżają zdolność takiego oczyszczania – wyjaśniają autorzy. – To natomiast prowadzi do naruszającej równowagę komórki akumulacji toksycznych białek, które zaczynają stanowić trudność dla przetrwania komórek. Nicienie, które tracą białka KLF, nie mogą przeprowadzać autofagii i umierają bardzo szybko.
Badacze planują kolejne działania. Chcą przede wszystkim przestudiować i odkryć precyzyjny mechanizm, który sprawia, że autorfagia w komórkach naczyń krwionośnych wspiera wzmocnienie ich działania. Ich kolejnym przedsięwzięciem będzie poszukiwanie strategii, jakimi białka KLF mogłyby być wprowadzane do ludzkich organizmów.
– Wraz ze starzeniem się społeczeństwa musimy coraz lepiej rozumieć, co dzieje się z naszymi sercami i tętnicami. Polegamy przecież na nich i liczymy, że będą nam służyły do coraz dłuższej starości. Nasze odkrycie naświetla to, co dzieje się w procesie starzenia i daje podstawy zmierzenia się ze spowolnieniem tego zjawiska – podsumowuje Nelson Hsieh.
Publikacja źródłowa:
Paishiun N. Hsieh et al, „A conserved KLF-autophagy pathway modulates nematode lifespan and mammalian age-associated vascular dysfunction”, „Nature Communications (2017)”. DOI: 10.1038/s41467-017-00899-5
Opracowano na podstawie artykułu „Worms reveal secrets of aging: Researchers discover a conserved pathway that controls aging” umieszczonego na portalu medicalxpress.com